
400-0569-812

| 类别 | 风险等级 | 监管途径 | 对企业要求 |
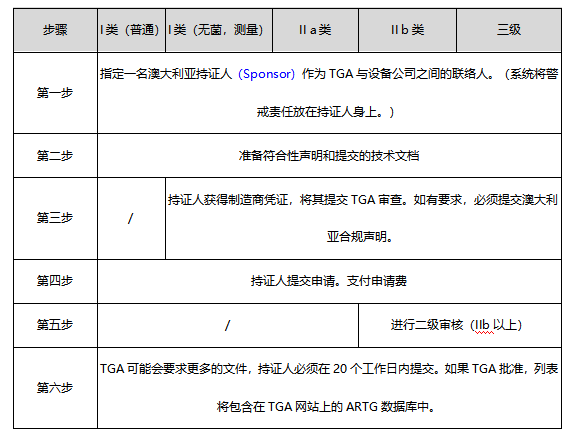
| 医疗器械MD | I类 | ARTG 列示 | l 编写符合法规要求的技术文档; l 委托持证人(Sponsor)在澳大利亚注册(需提交技术文档给持证人),注册后即可销售。 |
| I 类无菌 I 类测量 |
ARTG 列示 (合格评定证书) |
l 建立符合EN ISO 13485或MDSAP质量管理体系; l 编写符合法规要求的技术文档; l 由TGA进行审核,重点为:a)EN ISO 13485或MDSAP体系审核,必须包括设计开发过程;b)产品性能研究(各技术指标(具体视各产品而定);生物学评价...等)。 l 部分产品需提交临床研究报告 l 审核通过后,获得合格评定证书; l 委托持证人在澳大利亚注册(需提交技术文档、合格评定证书给持证人)。注册后即可销售。 |
|
| Ⅱa类 | |||
| Ⅱb类 | |||
| III类 |

上海欧必美医疗技术集团有限公司 版权所有 Copyright© 2022-2026 All rights reserved 沪ICP备19022935号-1