UDI
唯一器械标识(Unique Device Identification,缩写UDI),是一种在医疗器械产品或者包装上附载的,由数字、字母或者符号组成的代码,用以对医疗器械进行唯一性识别。
完整的UDI系统包括唯一标识、数据载体和数据库三部分。唯一标识是医疗器械产品的电子身份证;数据载体是存储或者传输医疗器械唯一标识的数据媒介;数据库是储存医疗器械唯一标识的产品标识与关联信息的数据库。
在信息时代背景下,UDI是实现医疗器械产品自动化识别、精准召回、追踪追溯、全过程通查通识、信息互联互通、智能化管理的关键基本要素。
UDI由哪些内容组成?
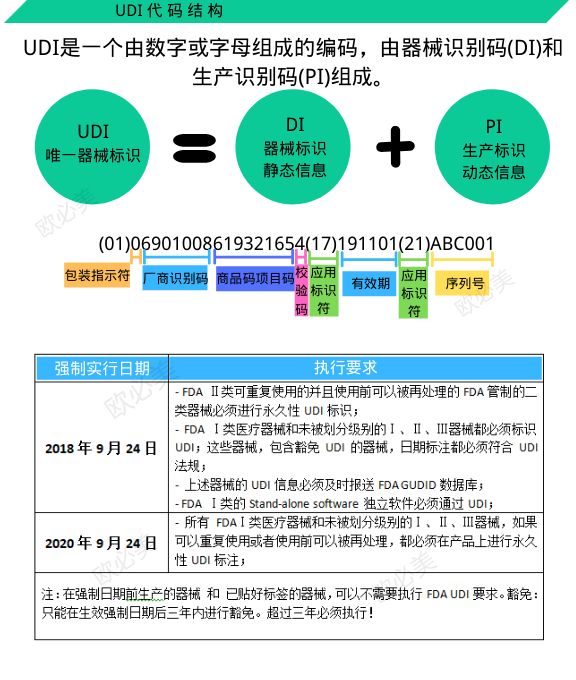
UDI由器械标识(Device Identification,DI)和(或)生产标识(Production Identification,PI)组成。
DI是UDI的必须、固定部分,由企业识别码和产品规格码两部分组成。企业识别码由注册人或备案人申请,由符合我国医疗器械编码规则和编码标准的发码机构依申请受理,并分配全球唯一的企业识别码;产品规格码是注册人或备案人根据其生产的产品型号、规格及包装等特征编制的代码。由企业标识码和产品规格码组成的DI是全球唯一的。
PI是医疗器械唯一标识的非必须、可变部分,包括生产日期、失效日期、批号或序列号等。PI的数据不需要上传编码数据库,所有单位可采用通用扫描设备在本地解析相关生产信息。
UDI应当符合唯一性、稳定性和可扩展性原则。唯一性是UDI的首要原则,确保产品的唯一标识不重复是精确识别的基础,也是唯一标识发挥功能的核心原则;稳定性原则要求UDI应当与产品基本特征相关,若产品的基本特征未变化,产品标识应当保持不变;可扩展性原则要求UDI应当适应监管要求和实际应用的不断发展。