
400-0569-812
2,公司做任何变化,K号不变,属于公司永久的无形固定资产
3,公司上市或被收购时,通常至少按10倍的价格做固定资产来估价
4,k号获得批准后续无需做任何工作,永久持有
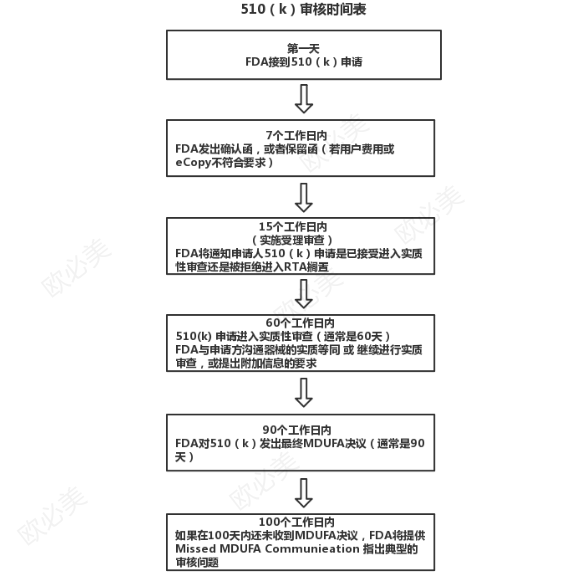
PS:FDA财政预算每年8月份左右公示下一年度的收费标准,每年费用递增标准是5-10%,越晚注册成本越高,法规要求也越高。
• 产品说明 – 产品名,等级,形状及结构,使用目的及其他产品信息
• 标示事项,关于灭菌的资料
• 性能标准 (Perfomance Standard): 记述适用于产品的性能标准
• 证明实质等同性的资料
• 试验检查报告书: 关于性能及生物符合性的试验检查结果资料
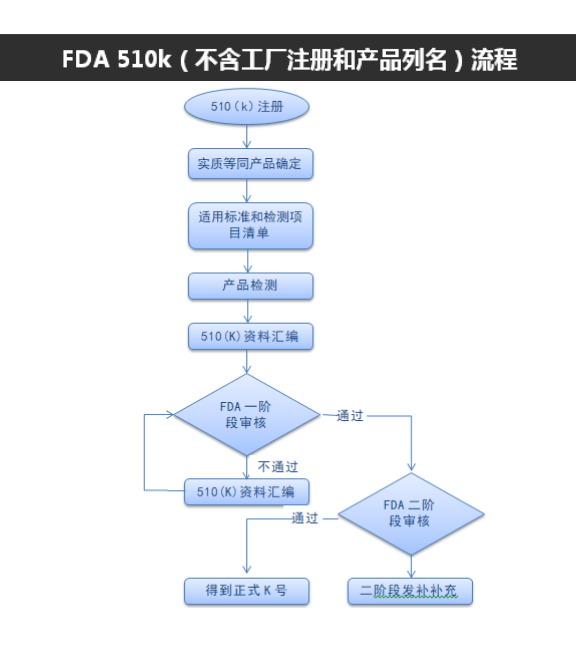
510(K) 上市前许可内容
PMA要求一般事项以外为安全性,有效性审核的追加资料,为最终认可追加GMP现场审核
• 前临床试验资料 (Preclinical Laboratory Testing Data)
- 关于器械及材料的物理,化学,机械特性的试验
- 对材料的毒性试验等生物符合性试验
• 动物试验资料 (Animal Testing Data)
- 新材料适用于变形材料,人工心脏起搏器等
• 临床试验报告资料 (Human Clinical Testing Data)
上海欧必美医疗技术集团有限公司 版权所有 Copyright© 2022-2026 All rights reserved 沪ICP备19022935号-1